Heredity and Evolution (Question Answer)


কার্বনৰ পৰমাণু ক্ৰমাংক 6 , ইয়াৰ যােজক ইলেক্ট্ৰনৰ সংখ্য়া 4 টা। সেয়েহে সম্ভ্ৰান্ত গেছৰ বিন্যাস লাভ কৰিবলৈ ই চাৰিটা ইলেক্ট্রন গ্রহণ বা ত্যাগ কৰিব লাগিব। কার্বনে ইলেক্ট্রন গ্রহণ বা ত্যাগ কৰাহেতেন—
(i) চাৰিটা ইলেক্ট্রন গ্রহণ কৰি C4- এনায়ন গঠন কৰিব লাগিব। কিন্ত ু কার্বন নিউক্লিয়াছত থকা ছয়টা প্র’টনে দহটা ইলেক্ট্রন (অর্থাৎ চাৰিটা অতিৰিক্ত ইলেকট্রন) ধৰি ৰখাটো সম্ভব নহয়।
(ii) সেইদৰে চাৰিটা ইলেকট্রন ত্যাগ কৰি C4+ কেটায়ন গঠন কৰিব লাগিব। চাৰিটা ইলেক্ট্রন আঁতৰাবলৈ বহু পৰিমাণৰ শক্তিৰ প্রয়ােজন হ'ব। আনহাতে কার্বন পৰমাণুৰ পৰমাণুগৰ্ভত ছয়টা প্র'টন থকাৰ বিপৰীতে মাত্র দুটাহে ইলেকট্রন থাকিব।
কার্বন পৰমাণুৱে তাৰ চাৰিওটা যােজক ইলেক্ট্রন আন কার্বন পৰমাণু বা আন মৌলৰ পৰমাণুৰ লগত ভাগবতৰা কৰি অণু গঠন কৰি এই সমস্যাৰ সমাধান কৰে। ভাগ-বতৰা কৰা ইলেকট্রনবিলাক (Shared electrons) অংশীদাৰ পৰমাণু দুয়ােটাৰ বহিৰতম কক্ষৰ উমৈহতীয়া ইলেকট্রন হৈ পৰে আৰু ইয়াৰ ফলত অংশীদাৰ পৰমাণু দুয়ােটাই সম্ভ্ৰান্ত গেছৰ ইলেকট্রন বিন্যাস লাভ কৰে।এইদৰে দুটা পৰমাণুৰ মাজত ইলেক্ট্রনৰ ভাগবতৰা হৈ গঠন হোৱা বান্ধনিক সহযোজী বান্ধনি বোলা হয়। সহযোজী অণুৰ বান্ধনিবিলাক দৃঢ় কিন্ত ু অণুবিলাকৰ মাজৰ আন্তঃআণৱিক বল (inter-molecular force) কম। সেইবাবে ইহঁতৰ গলনাংক আৰু উতলাংক নিম্ন। যিহেতু পৰমাণুৰ মাজত ইলেক্ট্রনৰ ভাগ-বতৰাহে হয়, কিন্ত ু কোনো আহিত কণিকাৰ সৃষ্টি নহয়; সেয়েহে সহযোজী যৌগবোৰ বিদ্যুৎ অপৰিবাহী।
এই ধৰণে সহযোজী বান্ধনিৰে গঠন হােৱা আটাইতকৈ সৰল অণু হ’ল হাইড্র'জেন। হাইড্র'জেনৰ পৰমাণু ক্রমাংক 1। গতিকে ইয়াৰ K কক্ষত এটা মাত্র ইলেক্ট্রন থাকে। K কক্ষ সম্পূর্ণ হ’বলৈ আৰু এটা মাত্র ইলেক্ট্রনৰ প্রয়ােজন। গতিকে দুটা হাইড্রজেন পৰমাণুৱে ইলেকট্রন ভাগ-বতৰা কৰি হাইড্রজেন অণু গঠন কৰে। ইয়াৰ ফলত প্ৰতিটো হাইড্র'জেন পৰমাণুৱে তাৰ নিকটতম সম্ভ্ৰান্ত গেছ হিলিয়ামৰ ইলেকট্রনীয় বিন্যাস লাভ কৰে। হাইড্র'জেন অণুৰ গঠন চিত্ৰৰ সহায়ত দেখুৱাব পাৰি।



মৌল হিচাপে কার্বন প্রকৃতিত বিভিন্ন ৰূপত থাকে। ইয়াকে বহুৰূপতা বোলে। ইহঁতৰ ভৌতিক ধর্মও
সমূলি পৃথক। হীৰা (diamond) আৰু গ্রেফাইট (graphite) কার্বনৰ বহুৰূপ। এই বহুৰূপ বিলাকত কার্বন পৰমাণুবোৰৰ বান্ধনি প্রকাৰ বেলেগ। হীৰাত প্ৰতিটো কার্বন পৰমাণুৱে আন
চাৰিটা কার্বন পৰমাণুৰ লগত বান্ধনি গঠন কৰি দৃঢ় ত্রিমাত্রিক গঠন (rigid
three dimensional structure) লাভ কৰে। গ্রেফাইটত প্ৰতিটো কার্বন পৰমাণুইৱে আন তিনিটা
কার্বন পৰমাণুৰ লগত একেখন সমতলতে বান্ধনিযুক্ত হৈ যড়ভূজী সজ্জা (Hexagonal
array) সৃষ্টি
কৰে। ইয়াত এডাল দ্বিবান্ধনিদ্বাৰা কার্বনৰ যোজ্যতা পূৰণ হয়। গ্রেফাইটত ষড়ভুজী
সজ্জাবোৰ তৰপে তৰপে প্রথিত হৈ থাকে।
এতিয়ালৈ আৱিষ্কৃত বা সংকেত জনা
কার্বন যৌগৰ সংখ্যা প্রায় তিনি নিযুত। এই বৃহৎ সংখ্যক কার্বন যৌগৰ তুলনাত আন আটাইবোৰ
মৌলৰে সৃষ্ট যৌগৰ সংখ্যা তেনেই নগন্য। কাৰণ কার্বন এক বিশেষ ধর্ম আছে যি আন মৌলৰ
নাই। সহযোজী বান্ধনিৰ ধৰ্মৰ বাবে কার্বনে অগণন যৌগ গঠন কৰিব পাৰে। কার্বনৰ
ক্ষেত্ৰত প্রত্যক্ষ কৰা দুটা প্রধান ধর্ম হল-
(i) কেটিনেচনঃ কার্বনে নিজৰ মাজতে বান্ধনি সৃষ্টি কৰি বৃহৎ সংখ্যক অণু গঠন কৰিব পাৰে। এই ধর্মকে কেটিনেচন (catenation) বুলি কোৱা হয়। যৌগবিলাকত কার্বনৰ দীঘল শৃংখল, শাখা শৃংখল নতুবা চক্রীয় শৃংখল পৰিলক্ষিত হয়। তদুপৰি কার্বন পৰমাণুবোৰ এক বান্ধনি, দ্বিবান্ধনি বা ত্রিবান্ধনিৰ দ্বাৰা যুক্ত হৈ থাকে। কার্বন পৰমাণুবোৰ এক বান্ধনিৰ সংযুক্ত হৈ সৃষ্টি হােৱা যৌগবোৰক সংপৃক্ত যৌগ (saturated compound) বােলে। দ্বিবান্ধানি বা ত্রিবান্ধনিযুক্ত যৌগবোৰক অসংপৃক্ত যৌগ (unsaturated compound) বোলা হয়।
(i) চতুৰ্সহ যোজ্য়তাঃ যিহেতু কার্বনৰ যোজ্যতা চাৰি গতিকে ই আন চাৰিটা কার্বন অথবা অন্য একযোজী মৌলৰ পৰমাণুৰ লগত সহযোজী বান্ধনি গঠন কৰিব পাৰে। অক্সিজেন, হাইড্র'জেন, নাইট্র'জেন, ছালফাৰ, ক্ল’ৰিণ আৰু আন বহুতো মৌলৰ লগত কার্বন লগ লাগি,বহুতো যৌগ গঠন হয় যাৰ ধৰ্ম বিশেষকৈ নিৰ্ভৰ কৰে এই অনাকার্বন মৌলটোৰ ওপৰত। ইয়াক যৌগটোৰ বিষম পৰমাণু (heteroatom) বোলে।। আনহাতে বেছি সংখ্যক মৌলৰ লগত দৃঢ় বান্ধনি গঠন কৰে বাবে যৌগবোৰ অতি সুস্থিৰ। কার্বনে দৃঢ় বান্ধনি গঠন কৰাৰ এটা কাৰণ হ'ল-ইয়াৰ ক্ষুদ্ৰ আকাৰ যাৰ ফলত পৰমাণুগৰ্ভত থকা প্ৰ'টনবিলাকে ভাগ বতৰা কৰা ইলেক্ট্রনযোৰ আকৰ্ষণ কৰি ৰাখিব পাৰে।
যিবিলাক কাৰ্বন যৌগৰ সকলোবোৰ পৰমাণুৰ যোজ্যতা এক বান্ধনিৰ জৰিয়তে পূৰণ কৰা হয়, এনেধৰণৰ যৌগক সংপৃত্ত যৌগ (saturated compound) বােলে। এই যৌগবোৰ সাধাৰণতে অধিক সক্রিয় নহয়। সংপৃত্ত যৌগ উদাহৰণ হল ইথেন।

কার্বন পৰমাণুৰ মাজত দ্বিবান্ধনি বা ত্রিবান্ধনি থকা যৌগবোৰক অসংপৃক্ত যৌগ (unsaturated Compound) বোলা হয়। সংপৃক্ত যৌগতকৈ ইহঁত বহুপৰিমাণে সক্রিয়।


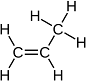

কার্বন আৰু হাইড্র'জেনৰ যৌগৰ উপৰিও আন মৌল যেনে হেল’জেন, নাইট্র'জেন, ছালফাৰ আদিৰ লগতাে কার্বন বান্ধনিযুক্ত হয়। একেডাল হাইড্র’কার্বন শৃংখলত এক বা ততােধিক হাইড্র'জেন পৰমাণু এইবােৰ মৌলৰদ্বাৰা প্রতিস্থাপিত কৰিব পাৰি। এনে কৰিলেও কার্বন যােজ্যতা চাৰি হৈয়ে থাকে। এইবিলাক যৌগত হাইড্রজেনৰ ঠাইত প্রতিস্থাপিত কৰা মৌলটোক বিষম পৰমাণু (Heteroatom) বুলি গণ্য কৰা হয়। এই বিষয়ে পৰমাণুবােৰ থুপ বা মূলক ৰূপেও (as a group) থাকিব পাৰে।
এই বিষম পৰমাণুবোৰ অকলশৰীয়াকৈ বা সিহঁতৰ একো একোটা থুপ বা মুলকৰ উপস্থিতিয়ে যৌগবােৰৰ ধর্ম নিৰ্দ্ধাৰণ কৰে।ধর্মবােৰ কার্বন শৃংখলৰ দৈর্ঘ্য বা প্ৰকৃতিৰ ওপৰত বিশেষ নির্ভৰ নকৰে। সেয়েহে এই মূলবােৰক কার্যকৰী মূলক (functional group) বােলে।
|
বিষম পৰমাণু |
কাৰ্ষৰকী মূলক |
কাৰ্ষৰকী মূলকৰ সংকেত |
|
ক্লৰিণ/ ব্ৰমিণ, অক্সিজেন |
হেল’- (ক্ল’ৰো/ব্ৰ’মো) |
-Cl,
-Br |
|
1.এলক’হল |
-OH |
|
|
2. এলডিহাইড |
|
|
|
3. কিট’ন |
-CO or |
|
|
4.কাৰ্বক্সিলিক এছিড |
-COOH or |
সমগণীয় শ্রেণীভূক্ত যৌগৰ নামকৰণ কৰিবলৈ মূল কার্বন শৃংখলযুক্ত
যৌগটোৰ নামৰ উপসর্গ (prefix) বা অনুসর্গ বা প্রত্যয় (suffix) হিচাপে কাৰ্যকৰী মূলকৰ নাম
সন্নিবিষ্ট কৰা হয়।
তলৰ পদ্ধতিৰে কার্বন যৌগৰ নামকৰণ কৰা
যায়—
(i) যৌগটোত থকা কার্বন পৰমাণুৰ সংখ্যা নির্ণয় কৰা হয়।
|
কাৰ্বন পৰমাণুৰ সংখ্য়া |
অনুসৰ্গ |
একবান্ধনি (-) |
দ্বিবান্ধনি (=) |
ত্ৰিবান্ধনি (≡) |
|
1 |
Meth
(মিথ) |
+
ane |
- |
- |
|
2 |
Eth
(ইথ) |
+
ane |
+ene |
+yne |
|
3 |
Prop
(প্ৰপ) |
+
ane |
+ene |
+yne |
|
4 |
But
(বিউট) |
+
ane |
+ene |
+yne |
|
5 |
Pent
(পেন্ট) |
+
ane |
+ene |
+yne |
|
6 |
Hex
(হেক্স) |
+
ane |
+ene |
+yne |
তিনিটা কার্বন থকা যৌগটোৰ নাম হ'ব প্র’পেন (propane) । থিক তেনেদৰে, তিনিটা কাৰ্বন থকা দ্বিবান্ধনিযুক্ত যৌগটোৰ নাম হব প্ৰপিন।
(ii) কার্যকৰী মূলক থাকিলে নামৰ উপসর্গ (prefix) বা অনুসর্গ (suffix) ত উল্লেখ কৰা হয়।
(iii) কার্যকৰীমূলকৰ নামটো অনুসৰ্গত
দিব লাগিলে কার্বন শৃংখলৰ নামৰ শেষৰ 'e' টোৰ | ঠাইত উপযুক্ত অনুসর্গ বা
প্রত্যয় লগোৱা হয়। উদাহৰণ কিটন মুলক থকা তিনিটা
কার্বনৰ যৌগৰ নাম হ'ব
Propane – e = Propan + 'one' =
Propanone
(iv) কার্বন শৃংখল অসংপৃত্ত হলে 'ane' ৰ ঠাইত 'ene' বা 'yne' যোগ দিয়া হয়। তিনিটা কার্বন পৰমাণুৰে গঠিত
দ্বিবান্ধনিযুক্ত যৌগটোক Propene আৰু ত্রিবান্ধনিযুক্ত যৌগক Propyne নাম দিয়া হয়।
|
কার্যকৰী মূলক |
উপসর্গ (prefix) |
অনুসর্গ (suffix) |
উদাহৰণ |
|
দ্বিবান্ধনি (এলকিন) |
- |
Ene |
CH3-CH=CH2 (প্ৰ’পিন) |
|
ত্ৰিবান্ধনি (এনকাইন) |
- |
Yne |
CH3-C≡C-H(প্ৰ’পাইন) |
|
ক্ল’ৰিণ (-Cl) |
ক্ল’ৰ’ (chloro) |
- |
CH3-CH2-CH2-Cl(ক্ল’ৰ’প্ৰপেন) |
|
ব্ৰ’মিন (-Br) |
ব্ৰ’ম’ (bromo) |
- |
CH3-CH2-CH2-Br(ব্ৰ’ম’প্ৰপেন) |
|
এলকহল (-OH) |
- |
ol |
CH3-CH2-OH(মিথানল) |
|
এলডিহাইড (-CHO) |
- |
al |
CH3-CH2-CHO(প্ৰপানেল) |
|
কিটন (-CO) |
- |
one |
CH3-CO-CH3(প্ৰপানন) |
|
কাৰ্বক্সিলিক এছিড (-COOH) |
- |
Oic acid |
CH3-CH2-COOH (প্ৰপানয়িক এছিড) |
1. দহন (Combustion): বহুৰূপতাৰ যিকোনো ৰূপতে কার্বন দহন কৰিলে কার্বন ডাই অক্সাইড উৎপন্ন হোৱাৰ উপৰিও তাপ আৰু পোহৰ উৎপন্ন হয়। প্রায়ভাগ যৌগ দহনত উৎপন্ন হোৱা তাপ উচ্চ পৰিমাণৰ হয়। দহন বিক্ৰিয়াবোৰ জাৰণ বিক্রিয়া
(i) C + O2 → CO2 + তাপ আৰু পোহৰ
(ii) CH4 + O2 → CO2 + H2O + তাপ আৰু পোহৰ
CH3-CH2OH ক্ষাৰকীয়
KMnO4+ তাপ→ CH3 COOH

CH4 + Cl2 → CH3Cl + HCl
(সূৰ্যৰ পোহৰত)
ইথানলৰ ধর্ম (Properties of ethanol) : সাধাৰণ উষ্ণতাত ইথানল জুলীয়া। ইথানলকে সাধাৰণতে
এলকহল বুলি কোৱা হয় আৰু ই এলকহলীয় পানীয়ৰ মুখ্য উপাদান তদুপৰি ই ভাল দ্ৰাৱক হোৱা
হেতুকে ইয়াক বিভিন্ন ঔষধ যেনে টিংচাৰ আয়’ডিন,
কফ চিৰাপ, টনিক আদি প্রস্ত ুতিত ব্যৱহাৰ কৰা হয়। ইথানল
পানীৰ লগত যিকোনো অনুপাতত মিহলি হয়। কম পৰিমাণৰ পনীয়া এলকহল সেৱনৰ ফলত নিচা হয়। কিন্ত ু বিশুদ্ধ
এলকহল (absolute alcohol) সামান্য পৰিমাণে সেৱন
কৰিলেও মৃত্যু হ'ব পাৰে।
ইথানলৰ বিক্রিয়া (Reactions of Ethanol) :
(i) ছ’ডিয়ামৰ
লগত বিক্রিয়াঃ
2Na + 2CHCH2OH → 2CH3CH20-Na+ + H2
(ii) অসংপৃক্ত হাইড্র’কার্বন প্রস্ত ুত কৰা বিক্রিয়াঃ 443K উষ্ণতাত অধিক পৰিমাণৰ গাঢ় ছালফিউৰিক এচিডৰ লগত ইথানল উত্তপ্ত কৰিলে ইথানলৰ নিৰুদন (dehydration) ঘটি ইথিন উৎপন্ন হয়।
CH3 CH2OH তপত
গাঢ় H2SO4→
CH2 = CH2 + H2O
গাঢ় ছালফিউৰিক এছিডক নিৰুদক দ্ৰৱ্য (dehydrating
agent) হিচাপে
গণ্য কৰা হয় যি ইথানলৰ পৰা পানী আঁতৰ কৰে।
2. ইথানয়িক এছিড (Ethanoic acid) ঃ ইথানয়িক এছিডৰ সদাব্যৱহৃত নাম হ’ল এচেটিক এছিড। ই কার্বক্সিলিক এছিড শ্রেণীৰ অন্তর্ভুক্ত। এচেটিক এছিডৰ 5–8% জলীয় দ্ৰৱণক ভিনেগাৰ বোলে। আচাৰ সংৰক্ষণত ইয়াক বহুলভাবে ব্যৱহাৰ কৰা হয়। ইথানয়িক এছিডৰ গলনাংক 290 K আৰু সেয়েহে ই ঠাণ্ডা জলবায়ুৰ দেশত শীতকালত গোট মাৰে। ইয়াৰ বাবে ইয়াক গ্লেছিয়েল এচেটিক এছিদ নাম দিয়া হয়।
কার্বক্সিলিক এছিড নামৰ জৈৱ যৌগ শ্রেণীক সিহঁতৰ বৈশিষ্ট্যপূর্ণ এছিড গুণৰদ্বাৰা চিনাক্তকৰণ কৰা হয়। পিছে খনিজ এছিড যেনে HCl যিদৰে সম্পূৰ্ণৰূপে আয়নিত হয়, কার্বক্সিলিক এছিডবোৰ নহয়।সেয়েহে ইহঁতক দুর্বল এছিড (weak acid) বোলা হয়।
ইথানয়িক এছিডৰ বিক্রিয়া (Reations
of ethanoic acid):
(i) এষ্টাৰিভৱন বিক্রিয়াঃ এছিড আৰু এলকহলৰ মাজত বিক্রিয়া ঘটিলে সাধাৰণতে
এষ্টাৰ উৎপন্ন হয়। এছিড অনুঘটকৰ উপস্থিতিত ইথানয়িক এছিড আৰু নির্ভেজাল এলকহলৰ (Absolute
alcohol) মাজত
বিক্রিয়া ঘটিলে এষ্টাৰ উৎপন্ন হয়।।
CH3COOH + CH3 CH2OH→ CH3COO-CH2CH3
এষ্টাৰ সুগন্ধি দ্ৰৱ। ইয়াক সুগন্ধি দ্ৰব্য় আৰু খাদ্য সুস্বাদুকাৰক হিচাপে ব্যৱহাৰ কৰা হয়।
(ii) চেপনিফিকেচন বা চাবোনীভৱন (Saponification) বিক্রিয়াঃ ছডিয়াম হাইড্র'ক্সাইডৰ (এটা ক্ষাৰ) লগত বিক্রিয়া ঘটিলে এষ্টাৰ পুনৰ এলকহল আৰু কার্বক্সিলিক এছিডৰ ছ’ডিয়াম লৱণলৈ ৰূপান্তৰিত হয়। এই বিক্রিয়াক চেপনিফিকেচন বা চাবোনীভৱন (Saponification) বিক্রিয়া হিচাপে জনা যায় কিয়নো চাবোন উৎপাদন ইয়াক ব্যৱহাৰ কৰা হয়।
CH3COOHC2H5 NaOH→ C2H5OH + CH3COONa
(iii) ক্ষাৰৰ লগত বিক্রিয়া (Reactions
with a base) ঃ খনিজ
এছিডৰ দৰে ইথানয়িক এছিডে ছ’ডিয়াম হাইড্র'ক্সাইড আদি ক্ষাৰৰ লগত
বিক্রিয়া কৰি লৱন (ছ’ডিয়াম
ইথান’য়েট
বা ছ’ডিয়াম এছিটেট) আৰু পানী উৎপন্ন
কৰে।
NaOH + CH3COOH → CH3COONa + H2O
(iv) কার্ব'নেট আৰু হাইড্র'জেন কার্বনেটৰ লগত বিক্রিয়াঃ ইথানয়িক এছিডে কার্বনেট আৰু হাইড্র'জেন কার্ব'নেটৰ লগত বিক্রিয়া কৰি লৱণ, কার্বন ডাই অক্সাইড আৰু পানী উৎপন্ন কৰে। উৎপন্ন হোৱা লৱণটোৰ সাধাৰণ নাম ছডিয়াম এছিটেট।
2CH3COOH + Na2CO3 → 2CH3COONa + H20+ CO2
CH3COOH + NaHCO3 → CH3COONa
+ H2O + CO2
বেছিভাগ মলি (dirt) তেলীয়া গুণযুক্ত । তেল পানীত অদ্রবণীয়। চাবোনৰ অণুবোৰ হৈছে দীর্ঘ শৃংখলযুক্ত
কার্বক্সিলিক এছিডৰ ছ’ডিয়াম
বা পটাছিয়াম লৱণ। চাবোনৰ আয়নীয় মেৰু পানীত দ্ৰৱণীয়; আনহাতে কার্বন শৃংখল তেলত দ্ৰৱণীয়।
এনেদৰে চাবোনৰ অনুবোৰে পানীত সমুচ্ছায় (aggregates)
ৰ
সৃষ্টি
কৰে যাক বা মাইছেল বা কর্ণাপুঞ্জ বোলে। ইয়াত অণুবোৰৰ অনাধ্ৰ ুবীয় মেৰুটো তেলৰ টোপালৰ
ফালে আৰু ধ্ৰ ুবীয়
মেৰুটো বাহিৰৰ ফালে থাকে। ইয়ে পানীত অবদ্ৰৱ বা ইমালচন (emulsion)
সৃষ্টি
কৰে। চাবোনৰ ফেনে এই ধৰণে কাপোৰৰ মলি পানীত দ্ৰৱীভূত হোৱাত
সহায় কৰে।

মাইছেল
Comments
Post a Comment
If you have any doubt please let me know