Heredity and Evolution (Question Answer)


ধাতু (Metal)
যিবিলাক মৌলই ধনাত্মক আয়ন গঠন কৰে সেইবিলাকেই হল ধাতু। লো, কপাৰ, এলুমিনিয়াম, ছডিয়াম আদি কিছুমান ধাতুৰ উদাহৰণ।
ধাতুৰ ভৌতিক ধৰ্ম (Physical properties of metals)
1. ধাতব দ্য়ুতি (lustre)- বিশুদ্ধ ধাতুৰ পৃষ্ঠ চিকমিকিয়া হয়। ইয়াক ধাতব দ্য়ুতি বোলে।
2. কাঠিন্য় (hardness)- সাধাৰণ উষ্ণতাত ধাতুবোৰ টান বা কঠিন।
3. ঘাতসহনীয়তা (malleability)- ধাতুবোৰক হাতুৰিৰে মৰিয়ালে ই ভাঙি নাযায়, চেপেটা হৈ যায়। ধাতুক হাতুৰিৰে মৰিয়াই পাতল পাত এচটা বনাব পাৰি। ধাতুৰ এই গুণক ঘাতসহনীয়তা বোলে।
4. নমনীয়তা (ductility)- ধাতুৰ পাত দীঘল কৰি তাঁৰলৈ পৰিৱৰ্তন কৰিব পাৰি। ধাতুৰ এই গুণক নমনীয়তা বোলে।
5. নিনাদী গুণ (sonorous)- ধাতুবোৰক কোবালে সুনাদী শব্দ কৰে। ইয়াকে ধাতুৰ নিনাদী গুণ বোলে
6. ধাতুৰ ৰং (colour)- ধাতুবোৰ সাধাৰণতে ৰূপালী, বগা, ধূসৰ বা সোনালী- হালধীয়া হয়।
7. তাপ আৰু বিদ্য়ুতৰ সুপৰিবাহী (Heat and electrical conductivity)- ধাতুৰ মাজেৰে তাপ আৰু বিদ্য়ুত পৰিবহন হব পাৰে।
8. গলনাংক( melting point)- ধাতুবোৰৰ গলনাংক বেছি।
অধাতু (Non-metals)
যিবিলাক মৌলই ইলেকট্ৰণ গ্ৰহন কৰি ঋণাত্মক আয়ন গঠন কৰে সেইবিলাককে অধাতু তুলি কোৱা হয়।
অধাতুৰ ভৌতিক ধৰ্ম (Physical properties of non-metals)
1. অধাতুবোৰে বিভিন্ন ৰং দেখুৱাই।
2. অধাতুবোৰ তাপ আৰু বিদ্য়ুতৰ পৰিবাহী নহয়।
3. অধাতুবোৰৰ দ্য়ুতি, সুনাদী বা ঘাত-সহনশীলতা গুণ নাই।
4. অধাতুবোৰৰ গলনাংক কম।
1. পাৰা হৈছে সাধাৰণ উষ্ণতাত জুলীয়া অৱস্থাত পোৱা একমাত্ৰ ধাতু।
2. ধাতুৰ গলনাংক বেছি, কিন্তু গেলিয়াম আৰু ছিজিয়াম ধাতুৰ গলনাংক নিচেই কম।
3. আয়ডিন অধাতু যদিও ধাতৱদ্যুতি সম্পন্ন।
4. কার্বন এটা অধাতু, পিছে ই বেলেগ বেলেগ অৱস্থাত থাকিব পাৰে। ইয়াৰ প্রতিটো অৱস্থাক বহুৰূপ (allotrope) বোলে। হীৰা কার্বনৰ বহুৰূপ—ই প্রকৃতিৰ সকলোতকৈ টান পদার্থ আৰু ইয়াৰ গলনাংক আৰু উতলাংকও অতি উচ্চ। কার্বনৰ আন এবিধ বহুৰূপ হৈছে গ্রেফাইট । ই আকৌ বিদ্যুতৰ পৰিবাহী।
5. ক্ষাৰ ধাতু (alkali metal) যেনে লিথিয়াম, ছ'ডিয়াম, পটাছিয়াম আদি ইমান কোমল যে ইহঁতক কটাৰীৰে কাটিব পাৰি। ইহঁতৰ ঘনত্ব কম আৰু গলনাংকও কম।
ধাতুৰ ৰাসায়নিক ধৰ্ম
1.
বতাহৰ সংস্পর্শত ধাতুদহন
প্রায় সকলো ধাতুৱেই অক্সিজেনৰ
লগত বিক্ৰিয়া কৰি ধাতৱ অক্সাইড উৎপন্ন কৰে।
ধাতু + অক্সিজেন → ধাতৱ অক্সাইড
উদাহৰণস্বৰূপে কপাৰ বতাহৰ
সংস্পৰ্শত উত্তপ্ত কৰিলে ই অক্সিজেনৰ লগত লগ লাগি কপাৰ (II) অক্সাইড উৎপন্ন কৰে। কপাৰ অক্সাইডৰ ৰং
কলা।
2Cu + 02
→ 2CuO
কপাৰ কপাৰ (II) অক্সাইড
সেইদৰে এলুমিনিয়ামে অক্সিজেনৰ লগত বিক্ৰিয়া কৰি এলুমিনিয়াম অক্সাইড উৎপন্ন
কৰে।
4Al + 302 →2Al203
2. ধাতুৰ পানীৰ লগত বিক্রিয়া
ধাতুৱে পানীৰ লগত বিক্রিয়া কৰি
ধাতৱ অক্সাইড আৰু হাইড্রজেন গেছ উৎপন্ন কৰে। পানী দ্ৰৱণীয় ধাতৱ অক্সাইডবোৰে পানীত
দ্ৰৱীভূত হৈ ধাতুৰ হাইড্রক্সাইড উৎপন্ন কৰে। অৱশ্যে সকলো ধাতুৱে পানীৰ লগত
বিক্রিয়া নকৰে।
ধাতু + পানী → ধাতৱ অক্সাইড + হাইড্রজেন।
ধাতৱ অক্সাইড + পানী → ধাতুৰ হাইড্রক্সাইড
ছডিয়াম আৰু
পটাছিয়াম ধাতুৱে ঠাণ্ডা পানীৰ লগত প্রবল বেগেৰে বিক্রিয়া কৰে। ছ'ডিয়াম আৰু পটাছিয়ামৰ ক্ষেত্ৰত
বিক্রিয়াটো ইমান বেছি প্রবল আৰু তাপবর্জী (exothermic)
যে
উৎপন্ন হোৱা হাইড্রজেন গেছ নিমিষতে জ্বলি উঠে।
2K(s) +
2H2O(l) →
2KOH(aq) + H2(g) + তাপশক্তি
2Na(s)
+ 2H2O(l) →
2NaOH(aq) + H2(g) + তাপশক্তি
পানীৰ লগত কেলছিয়ামৰ বিক্রিয়া
বেগ কম প্রবল (less violent)। বিক্রিয়াত উৎপন্ন হোৱা তাপ
হাইড্রজেন গেছ জ্বলি উঠিবৰ বাবে পর্যাপ্ত নহয়।
Ca(s) + 2H2O(l) →
Ca(OH)2(aq) + H2(g)
এইক্ষেত্ৰত কেলছিয়াম ধাতু
পানীত ওপঙিবলৈ লয় কিয়নো উৎপন্ন হোৱা হাইড্রজেন গেছ ধাতুৰ পৃষ্ঠতলত লাগি ধৰে।
মেগনেছিয়ামে ঠাণ্ডা পানীৰ লগত বিক্রিয়া নকৰে। ই গৰম পানীৰ লগত বিক্রিয়া কৰি
মেগনেছিয়াম হাইড্রক্সাইড আৰু হাইড্রজেন উৎপন্ন কৰে। মেগনেছিয়ামৰ পৃষ্ঠতলতো
হাইড্রজেন গেছ লাগি ধৰে বাবে ই ওপঙিব ধৰে।
এলুমিনিয়াম, আইন, যিংক আদি ধাতুৱে ঠাণ্ডা অথবা
গৰম পানীৰ লগত বিক্রিয়া নকৰে। কিন্তু সিহঁতে উতলা পানীৰ বাষ্পৰ লগত বিক্রিয়া কৰি
ধাতৱ অক্সাইড আৰু হাইড্রজেন উৎপন্ন কৰে।।
2Al(s) + 3H2O(g) →
Al2O3(s) +
3H2(g)
3Fe(s)+
4H2O(g) → Fe304 (s) +
4H2(g)
ইফালে লেড, কপাৰ, ৰূপ, সোণ আদি ধাতুৱে পানীৰ লগত মুঠেই
বিক্রিয়া নকৰে।
3. এছিডৰ লগত ধাতুৰ বিক্রিয়া
ধাতুৱে এছিডৰ লগত বিক্রিয়া কৰি
লৱণ আৰু পানী উৎপন্ন কৰে।
ধাতু + লঘূ এছিড → ধাতৱ লৱণ + হাইড্ৰজেন
অধিক সক্রিয় ধাতুৱে কম সক্রিয় ধাতুৰ লৱণৰ দ্ৰৱণ বা গলিত লৱণৰ পৰা কম সক্রিয় ধাতুটো অপসাৰিত কৰিব পাৰে।
Fe(s) + CuSO4(aq) ---→FeSO4 (aq) + Cu(s)
আইৰণ কপাৰতকৈ অধিক সক্ৰিয় হোৱা বাবে ইয়াক অপসাৰিত কৰিছে।
4. ধাতু আৰু অধাতুৰ মাজত বিক্ৰিয়াঃ ধাতু আৰু অধাতুৰ মাজত বিক্ৰিয়া হলে সিহঁতৰ মাজত ইলেকট্ৰনৰ আদান প্ৰদান হয়। ধাতুৱে এৰি দিয়া ইলেকট্ৰন অধাতুটোৱে গ্ৰহণ কৰে আৰু সিহঁতৰ মাজত আয়নীয় বান্ধনিৰ দ্বাৰা এটা নতুন যৌগৰ সৃষ্টি হয়।
উদাহৰণ হিচাপে আমি ছডিয়াম আৰু ক্লৰিণৰ মাজত হোৱা বিক্ৰিয়াটো চাব পাৰো।
ছ'ডিয়াম পৰমাণুৰ বহিৰতম কক্ষত এটা ইলেকট্ৰন থাকে (2.8.1)। এই ইলেকট্ৰনটো ছ'ডিয়ামে এৰি দিলে ইয়াৰ বহিৰতম কক্ষ হব দ্বিতীয় কক্ষ (L) আৰু ই সুস্থিৰ অষ্টক (2.8) লাভ কৰি কেটায়ন (Na+) গঠন কৰিব। আনহাতে ক্ল'ৰিনৰ বহিৰতম কক্ষত 7 টা ইলেকট্ৰন আছে।ই এটা ইলেকট্ৰন গ্ৰহন কৰি সুস্থিৰ অষ্টক বিন্য়াস লাভ কৰে। ছ'ডিয়াম আৰু ক্লৰিনৰ মাজত বিক্ৰিয়া ঘটিলে ছ'ডিয়ামে এৰি দিয়া ইলেকট্ৰনটো ক্লৰিনে গ্ৰহন কৰে আৰু এনায়ন (Cl-)গঠন কৰে। ইলেকট্ৰন আদান প্ৰদান প্ৰক্ৰিয়াটো চিত্ৰত দেখুওৱা হ'ল।
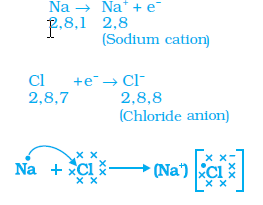
ছডিয়াম আৰু ক্লৰাইড আয়ন দুটা বিপৰীত আধানযুক্ত হোৱা হেতুকে পৰস্পৰে পৰস্পৰক আকৰ্ষণ কৰে আৰু দৃঢ় বিদ্য়ুত আকৰ্ষণীয় বলৰদ্বাৰা বান্ধ খাই ছডিয়াম ক্লৰাইড গঠন হয়। এই যৌগবোৰক আয়নীয় যৌগ বোলে।
আয়নীয় যৌগৰ ধর্ম
(1) ভৌতিক ধর্ম- যিহেতু আয়নীয় যৌগবোৰ ধনাত্মক আৰু ঋণাত্মক আধানৰ মাজৰ
শক্তিশালী বিদ্যুৎস্থিতীয় আকর্ষণীয় বলৰ দ্বাৰা গঠন হয় সেয়ে আয়নীয় যৌগবোৰ কঠিন বা গোটা
আৰু কিছু দৃঢ়
(2) এই যৌগবোৰ চনকা (brittle)
আৰু চাপ
প্রয়োগ কৰিলে সহজে ভাগি টুকুৰা টুকুৰ হয়।
(3) গলনাংক আৰু উতলাংক—
আন্তঃ
আয়নীয় বিদ্যুৎস্থিতীয় আকর্ষণ বল অতি প্রবল হোৱা বাবে ইহঁতক ভাঙি আয়নবোৰ পৃথক
কৰিবলৈ ভালেখিনি তাপশক্তিৰ প্ৰয়োজন হয়, সেয়ে আয়নীয় যৌগৰ গলনাংক আৰু উতলাংক
অতি বেছি।
(4)
দ্ৰৱণীয়তা—ইলেক্টযোজী যৌগবিলাক পানীত
দ্ৰৱণীয় আৰু কেৰাচিন, পেট্রল
আদি দ্ৰাৱকত
অদ্ৰৱণীয়।
(5) বিদ্যুত পৰিবাহিতা- দ্ৰৱণৰ মাজেদি বিদ্যুৎ চালিত কৰিলে আধানযুক্ত কণিকাৰ চলন আৰম্ভ হয়। আয়নীয় যৌগ পানীত দ্রবীভূত কৰি পোৱা দ্রৱৰ আয়নবিলাক বিদ্যুৎ প্রবাহৰ লগে লগে বিপৰীত ইলেক্ট্র’ডলৈ গতি কৰে। কঠিন অৱস্থাত আয়নীয় যৌগই বিদ্যুৎ পৰিবহন নকৰে; কিয়নো ইহঁতৰ দৃঢ় গঠনৰ বাবে আয়নৰ লৰচৰ সম্ভৱ নহয়। কিন্তু বিগলিত অৱস্থাত আয়নীয় যৌগৰ মাজেৰে বিদ্যুৎ পৰিবহন সম্ভৱ।
ধাতুবিলাকৰ উৎস
ধাতুবিলাক
মৌল বা যৌগ হিচাপে প্ৰকৃতিত পোৱা যায়।পৃথিৱীৰ খোলাটো ধাতুৰ প্রধান উৎস। সাগৰৰ
পানীতো দ্ৰৱণীয় লৱণ কিছুমান—যেনে ছ'ডিয়াম ক্ল’ৰাইড, মেগনেছিয়াম ক্ল’ৰাইড আদি থাকে। পৃথিৱীত মৌল বা
যৌগ অৱস্থাত ভূত্বকত পোৱা পদার্থবোৰক খনিজ পদার্থ বা মণিক (minerals)
বুলি
কোৱা হয়। কিছুমান খনিজ পদার্থত কোনো এবিধ ধাতুৰ পৰিমাণ অধিক থাকে আৰু তাৰ পৰা
ধাতুবিধ লাভজনকভাৱে আহৰণ কৰিব পাৰি। এই ধৰণৰ খনিজ পদার্থবিধক ধাতুটোৰ আকৰিক বা আকৰ
(ore) বুলি কোৱা হয়।
ধাতু আহৰণঃ ধাতুবোৰৰ সক্রিয়তাৰ ক্ৰম প্রয়োগ কৰি ধাতুবোৰ আকৰৰ পৰা নিষ্কাশন বা আহৰণ কৰা হয়। কিছুমান ধাতু প্ৰকৃতিত মুক্ত অৱস্থাত থাকে। প্রায়ভাগেই যৌগ অৱস্থাত থাকে। সক্রিয়তা শ্ৰেণীৰ তলৰফালে স্থানপ্রাপ্ত ধাতুবোৰ কম সক্রিয় বা নিষ্ক্রিয়। সিহঁতক মুক্ত অৱস্থাত পাব পাৰি। উদাহৰণস্বৰূপে গল্ড, ছিলভাৰ, প্লেটিনাম, কপাৰ আদি প্ৰকৃতিত মুক্ত অৱস্থাত পোৱা যায় কপাৰ আৰু ছিলভাৰ ছালফাইড বা অক্সাইড আকৰ হিচাপেও পোৱা যায়। সক্রিয়তা শ্ৰেণীৰ ওপৰৰ ধাতুবোৰ (K, Na, Ca, Mg, Al) ইমান সক্রিয় যে এইবিলাক কেতিয়াও মুক্ত মৌল হিচাপে পোৱা নাযায়। সক্রিয়তা শ্ৰেণীৰ মাজত অৱস্থিত ধাতুবোৰ (Zn, Fe, Pb আদি) মজলীয়াভাৱে সক্রিয়। ইহঁতক প্ৰধানকৈ যৌগ হিচাপে পোৱা যায় সৰহভাগ ধাতুৰে আকৰবোৰ সিহঁতৰ কিছুমান অক্সাইড। কাৰণ অক্সিজেন এটা অতিশয় সক্রিয় মৌল আৰু ইয়াক প্ৰকৃতিত পর্যাপ্ত পৰিমাণে পোৱা যায়। আনহাতে ছালফাইড আৰু কাৰ্বনেট ৰূপটো ধাতুৰ আকৰবোৰ পোৱা যায়। ধাতুবোৰৰ সক্ৰিয়তাৰ ওপৰত নিৰ্ভৰ কৰি ইহঁতক আহৰণ কৰিবলৈ বেলেগ বেলেগ পদ্ধতি ব্য়ৱহাৰ কৰা হয়।
আকৰৰ পৰা বিশুদ্ধ ধাতু নিষ্কাশনৰ ঢাপঃ আকৰৰ পৰা বিশুদ্ধ ধাতু নিষ্কাশনৰ কেইবাটাও ঢাপ থাকে।একাদিক্ৰমে এই ঢাপবিলাক হল-
আকৰ → আকৰ গাঢ়ীকৰণ →
গাঢ় আকৰক ধাতব অক্সাইডলৈ পৰিৱৰ্তন →
ধাতুলৈ বিজাৰণ → ধাতু বিশুদ্ধিকৰণ
(a) আকৰ গাঢ়ীকৰণঃ খনিৰ পৰা আহৰণ কৰা সময়ত আকৰৰ লগত বহুতো অশুদ্ধি যেনে মাটি, বালি আদি মিহলি হৈ থাকে। এই
অশুদ্ধি বা অপদ্ৰব্যবোৰক খনিজ মল (gangue)
বোলে।
ধাতুনিষ্কাশনৰ আৰম্ভণিতে এই অপদ্ৰব্যবোৰক আঁতৰ কৰা হয়।এই প্ৰক্ৰিয়াক আকৰ গাঢ়ীকৰণ বোলে। আকৰ আৰু অপদ্রব্যৰ ভৌতিক আৰু
ৰাসায়নিক ধৰ্মৰ ওপৰত নিৰ্ভৰ কৰি খনিজ মল আঁতৰাবলৈ বেলেগ বেলেগ পদ্ধতি প্রয়োগ কৰা
হয় । সাধাৰণতে আকৰ গাঢ়ীকৰণৰ বাবে প্ৰয়োগ কৰা পদ্ধতিবোৰ হল-
1.
ৰাসায়নিক পদ্ধতি
2.
চুম্বকীয় পদ্ধতি
3.
ফেন ওপঙন পদ্ধতি
4.
নিক্ষালন আদি
(b) গাঢ়
আকৰক ধাতব অক্সাইডলৈ পৰিৱৰ্তনঃ ধাতুৰ আকৰ বিলাক সাধাৰণতে কাৰ্বনেট আৰু ছালফেট
হিচাপে পোৱা যায়। এই কাৰ্বনেট আৰু ছালফেট আকৰ বোৰক অক্সাইডলৈ পৰিৱৰ্তন কৰি লোৱা
হয়, কাৰণ ধাতুৰ অক্সাইড সহজে বিজাৰিত কৰি ধাতুটো পাব পাৰি। আকৰ বোৰক অক্সাইডলৈ
পৰিৱৰ্তন কৰিবলৈ সাধাৰণতে দুটা পদ্ধতি ব্য়ৱহাৰ কৰা হয়-
1.
তাপজাৰণ
2.
দগ্ধীকৰণ
(c) ধাতব
অক্সাইডক ধাতুলৈ বিজাৰণঃ ধাতব অক্সাইডবোৰক ধাতুটোৰ সক্ৰিয়তাৰ
ওপৰত ভিত্তি কৰি উপযুক্ত বিজাৰক পদাৰ্থ ব্য়ৱহাৰ কৰি যথাযথ ধাতুলৈ বিজাৰণ কৰা হয়।
সাধাৰণতে এই ক্ষেত্ৰত দুটা পদ্ধতি ব্য়ৱহাৰ কৰা হয়- কাৰ্বন বিজাৰণ আৰু বিদ্য়ুত
বিজাৰণ।
(d) ধাতু
বিশুদ্ধিকৰণ বা
ধাতুৰ শোধনঃ ধাতু এটা আকৰৰপৰা আহৰণ কৰাৰ পিছত তাত অন্য় ধাতুৰ অৱশেষ আৰু আন কিছুমান
অশুদ্ধি থাকি যায়।এই অশুদ্ধিবোৰক আঁতৰ কৰাকে ধাতু বিশুদ্ধিকৰণ বা
ধাতুৰ শোধন বোলা হয়। ধাতু বিশুদ্ধিকৰণ বা ধাতুৰ শোধনৰ বাবে
সাধাৰণতে দুটা পদ্ধতি ব্য়ৱহাৰ কৰা হয়-
1. পাতন পদ্ধতি
2. বিদ্য়ুত পৰিশোধন পদ্ধতি
নিম্নসক্রিয়তাৰ ধাতু নিষ্কাশন
সক্রিয়তা শ্ৰেণীৰ তলৰফালে থকা
ধাতুবোৰ প্রায় নিষ্ক্ৰিয়। এইবিলাক ধাতুৰ অক্সাইড উত্তপ্ত কৰি ধাতুলৈ বিজাৰিত কৰিব পাৰি। যেনে
চিনাবাৰ (HgS) মাৰকিউৰিৰ এটা আকৰিক। বতাহৰ উপস্থিতিত ইয়াক উত্তপ্ত কৰিলে প্ৰথমতে
মাৰকিউৰিক অক্সাইড (HgO) উৎপন্ন হয়। পিছত আৰু অধিক উত্তপ্ত কৰিলে মাৰকিউৰিক
অক্সাইড মাৰকিউৰিলৈ বিজাৰিত হয়।
2HgS (s) + 3O2 (g) → 2HgO (s) + 2SO2 (g)
2HgO (s) তাপ→
2Hg
(l) + O2 (g)
সেইদৰে কপাৰৰ আকৰিক Cu2S বতাহৰ উপস্থিতিত উত্তপ্ত কৰি কপাৰ ধাতু পোৱা যায়।
2Cu2S (s) +
302 (g) →
2Cu2O (s) +
2SO2 (g)
2Cu2O (s)
+ Cu2S (s)
→ 6 Cu (s) + SO2 (g)
মধ্যম সক্রিয় ধাতু নিষ্কাশন
সক্রিয়তা শ্ৰেণীৰ মাজভাগত থকা
ধাতু যেনে আইৰণ, জিংক, লেড, কপাৰ আদি ধাতুবোৰ মজলীয়াভাৱে সক্রিয়। প্রকৃতিত এই ধাতুবোৰ ছালফাইড বা
কার্বনেট আকৰিক ৰূপত পোৱা যায়। ছালফাইড আৰু কার্বনেট আকৰৰ তুলনাত অক্সাইড আকৰৰ
পৰা ধাতু নিষ্কাশন সহজ। সেইকাৰণে বিজাৰণ কৰাৰ আগেয়ে ধাতৱ ছালফাইড আৰু কার্বনেট
আকৰ ধাতৱ অক্সাইডলৈ পৰিৱর্তিত কৰা হয়।ইয়াৰ বাবে সাধাৰণতে দুটা পদ্ধতি ব্য়ৱহাৰ কৰা
হয়।
1.
তাপজাৰণ (roasting) - অতিৰিক্ত বায়ুৰ উপস্থিতিত
উচ্চ তাপত উত্তপ্ত কৰি ছালফাইড আকৰক ধাতৱ অক্সাইডলৈ ৰূপান্তৰিত কৰা
হয়। এই পদ্ধতিক তাপজাৰণ বোলে।
ZnS
(s) + 3O2 (g) তাপ→ 2ZnO (s) + 2SO2
(g)
2.
দগ্ধীকৰণ (calcination) -
পৰিমিত বায়ুৰ পৰিবেশত উচ্চতাপত উত্তপ্ত কৰি
কার্বনেট আকৰ ধাতৱ অক্সাইডলৈ পৰিৱৰ্তিত কৰা হয়। ইয়াকে দগ্ধীকৰণ বোলে।
ZnCO3
(s) → ZnO (s) + CO2 (g)
এইদৰে পোৱা ধাতৱ অক্সাইডবোৰ
পিছত উপযুক্ত বিজাৰক যেনে কার্বন ব্যৱহাৰ কৰি যথাযথ ধাতুলৈ বিজাৰিত কৰা হয়।
উদাহৰণ হিচাপে যিংক অক্সাইড কার্বনৰ লগত উত্তপ্ত কৰিলে ধাতৱ যিংকলৈ বিজাৰিত হয়।
ZnO(s)
+ C(s) → Zn(s) + CO(g)
ধাতব
অক্সাইডক ধাতুলৈ বিজাৰিত কৰিবলৈ প্ৰতিস্থাপন বিক্ৰিয়াও ব্য়ৱহাৰ কৰিব পাৰি। অধিক
সক্ৰিয় ধাতু যেনে ছডিয়াম, পটাছিয়াম, কেলছিয়াম, এলুমিনিয়াম আদি ধাতুক বিজাৰক হিচাপে
ব্য়ৱহাৰ কৰিব পাৰি, কিয়নো ইহঁতে কম সক্ৰিয় ধাতুৰ যৌগৰ পৰা ধাতুটো প্ৰতিস্থাপিত
কৰিব পাৰে।
3MnO2(s) + 4Al(s) →
3Mn(l) + 2Al2O3(s) + Heat
উচ্চ সক্রিয়তাৰ ধাতু নিষ্কাশন
সক্রিয়তা শ্ৰেণীৰ একেবাৰে ওপৰৰ
ফালে পোৱা অতি সক্রিয় ধাতু যেনে ছডিয়াম, মেগনেছিয়াম, কেলছিয়াম, এলুমিনিয়াম আদিৰ ধাতৱ অক্সাইডবোৰক
কাৰ্বনৰ লগত উত্তপ্ত কৰিলে ধাতুটো পোৱা নাযায়। কিয়নো এইবোৰ ধাতুৰ অক্সিজেনৰ প্রতি
আসক্তি কার্বনতকৈ অধিক। এইবোৰ ধাতু বিদ্যুৎ বিজাৰণৰ (electrolytic
reduction) দ্বাৰা পোৱা
যায়। যেনে ছডিয়াম, মেগনেছিয়াম, আৰু কেলছিয়াম ধাতু সিহঁতৰ
বিগলতি ক্ল'ৰাইডৰ
বিদ্যুৎ
বিশ্লেষণৰ দ্বাৰাই পোৱা যায়। কেথ’ডত ধাতুটো জমা হয় আৰু এন’ডত ক্ল'ৰিন গেছ মুক্ত হয়। জৰিত বিক্রিয়াবোৰ
হ’ল—
কেথ’ডত Na++ e- →Na
এনডত 2Cl- → Cl2 + 2e-
ধাতু বিশুদ্ধিকৰণ/ ধাতুৰ শোধন
বিভিন্ন বিজাৰণ পদ্ধতিৰে পোৱা ধাতুবোৰ বিশুদ্ধ নহয়। ইহঁতৰ লগত কিছুমান অশুদ্ধি থাকে। এই অশুদ্ধিবোৰ আঁতৰ কৰিহে বিশুদ্ধ ধাতু পাব পাৰি। অশুদ্ধিযুক্ত ধাতু শোধন কৰিবলৈ বহুলভাৱে ব্যৱহাৰ হোৱা পদ্ধতিটো হল— বিদ্যুৎ পৰিশোধন পদ্ধতি (Electrolytic Refining) । কপাৰ, যিংক, টিন, নিকেল ছিলভাৰ, গোল্ড আদি ধাতু এই পদ্ধতিৰে শোধন কৰা হয়।
এই পদ্ধতিত অশুদ্ধ ধাতুৰ এন'ড আৰু বিশুদ্ধ ধাতুৰ পাত এচলা কেথ'ড হিচাপে ব্য়ৱহাৰ কৰা হয়। ধাতুটোৰ লৱণৰ দ্ৰৱ এটা
বিদ্য়ুত বিশ্লেষ্য় হিচাপে লোৱা হয়। বিদ্য়ুত বিশ্লেষ্য়ৰ মাজেৰে বিদ্য়ুত প্ৰবাহ
চালিত কৰিলে এন'ড হিচাপে
ব্য়ৱহাৰ কৰা অশুদ্ধ ধাতুৰ পাতৰ পৰা বিশুদ্ধ ধাতুখিনি দ্ৰৱীভূত হয়। একে পৰিমানৰ
বিশুদ্ধ ধাতু বিদ্য়ুত
বিশ্লেষ্য়ৰ পৰা গৈ কেথ'ডত জমা
হয়। এনেদৰে আমি কেথ'ডত
বিশুদ্ধ ধাতু পাওঁ।

ক্ষয়প্রতিৰোধঃ ক্ষয়ীভবন ৰোধ কৰিবলৈ তলত দিয়া পদ্ধতিবোৰ প্রয়োগ কৰিব পাৰি
1. ৰং কৰা (painting)- ক্ষয়ীভবন ৰোধ কৰিবলৈ ধাতুৰ পৃষ্ঠভাগত ৰং
কৰি দিয়া হয় যাতে ধাতুটো পোনপটীয়াকৈ জলীয় বাষ্প আদিৰ সংস্পৰ্শলৈ আহিব নোৱাৰে।
2. তেল সনা (oiling)- ধাতুৰ ওপৰত তেল সানিলেও ইয়াক
ক্ষয়ীভৱণৰ পৰা ৰক্ষা কৰিব পাৰি।
3. গ্রীজসনা (greasing)- ধাতুৰে নিৰ্মিত যন্ত্ৰপাতিৰ
সংযোগস্থল বিলাকত গ্ৰীজ ব্য়ৱহাৰ কৰি সেই স্থান বিলাকত হোৱা ক্ষয়ীভৱণ ৰোধ কৰিব
পাৰি।
4. দস্তালেপন (galvanizing)- দস্তালেপন হ’ল ষ্টিল আৰু লোত মামৰ নধৰিবৰ
বাবে যিংকৰ আৱৰণ দিয়া এটা পদ্ধতি। দস্তালেপিত বস্তুবোত দস্তাৰ প্রলেপ আঁতৰি যোৱাৰ
পিছতো মামৰে নধৰে।
5. ক্ৰমপ্লেটিং (chrome plating)- এই পদ্ধতিত ধাতুৰ ওপৰত বিদ্য়ুত বিশ্লেষণ পদ্ধতিৰে ক্ৰমিয়াম ধাতুৰ এটা পাতল তৰপ এটা দি লোৱা হয়
6. সংকৰ ধাতুঃ সংকৰ ধাতু প্রস্তুত কৰি ধাতৱ গুণাগুণ উন্নত কৰা হয়।
Thanks for sharing valuable information, this is the best website for education
ReplyDelete